Temperatura
La temperatura es una magnitud referida a las nociones comunes de caliente, tibio o frío que puede ser medida con un termómetro. En física, se define como una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como energía cinética, que es la energía asociada a los movimientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones. A medida de que sea mayor la energía cinética de un sistema, se observa que éste se encuentra más caliente; es decir, que su temperatura es mayor.
Dilatación Térmica
Se denomina dilatación térmica al aumento de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al aumento de temperatura que se provoca en él por cualquier medio. La contracción térmica es la disminución de propiedades métricas por disminución de la misma.
Dilatacion lineal: El coeficiente de dilatación lineal, designado por αL, para una dimensión lineal cualquiera, se puede medir experimentalmente comparando el valor de dicha magnitud antes y después de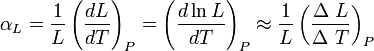 left}} Donde
left}} Donde  , es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura
, es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura 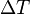 a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
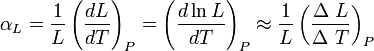 left}} Donde
left}} Donde  , es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura
, es el incremento de su integridad física cuando se aplica un pequeño cambio global y uniforme de temperatura 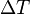 a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
a todo el cuerpo. El cambio total de longitud de la dimensión lineal que se considere, puede despejarse de la ecuación anterior:
Donde:
- α=coeficiente de dilatación lineal [°C-1]
- L0 = Longitud inicial
- Lf = Longitud final
- T0 = Temperatura inicial.
- Tf = Temperatura final
- Dilatacion superficial: La dilatacion superficial es cuando un cuerpo al cambiar la temperatura sufre cambio en su area y se encuentra mediante la expresion:
- A= Ao (1+2αΔt)
- A: area final
- Ao: area inicial
- α: coheficiente de dilatacion
- Δt: variacion de la temperatura: tf=ti
El calor
El calor está definido como la forma de energía que se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa simplemente transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico.
Transferencia de calor: El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
Expresiones del calor:
Capacidad calorica: C= Q/ Δt
Calor especifico: c= Q/ mΔt
Q: Calor suministrado
Δt: variacion de la temperatura
m: masa de la sustancia
Calor y cambios de estado
En física y química se denomina cambio de estado la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas.
Primera ley de la termodinámica
También conocida como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
La energía no se crea ni se destruye: solo se transforma.
Esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna.
La ecuación general de la conservación de la energía es la siguiente:

Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
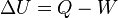
Segunda ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el primer principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía, de tal manera que, para un sistema aislado, la variación de la entropía siempre debe ser mayor que cero.


![L_f = L_0 [1 +\alpha_L (T_f - T_0)]\;](http://upload.wikimedia.org/math/4/d/8/4d8d9e521d59aa36de0d776706db3b16.png)


No hay comentarios:
Publicar un comentario